NASCIS 3 compararon la
eficacia de una dosis de 24 horas de MP con una dosis de 48 horas de MP
o el tirilazad de no-glucocorticoid, que fue incluido para acertar si
tuvo la eficacia de MP sin poseer los efectos secundarios de
esteroide-relacionado con MP (Bracken et al, JAMA 277(2), 1997). Basado
en los resultados de estudios previos del NASCIS 2, todos 499 sujetos
agudamente heridos fueron dados inicialmente dosis de 30 mg/kg de MP
dentro de ocho horas de la herida. Entonces, los pacientes fueron
escogidos al azahar a recibir 1) una infusión 5.4-mg/kg de MP por 24
horas, 2) la misma dosis por 48 horas, o 3) 2.5 mg/kg de tirilazad cada
seis horas durante 48 horas.
Las evaluaciones de
seguimiento otra vez fueron llevadas a cabo en seis semanas y seis meses.
Los investigadores concluyeron que si MP es administrada inicialmente
dentro de tres horas de la herida, el régimen debe ser continuado por 24
horas; si se inicia tres a ocho horas después de la herida, el régimen
debe ser continuado durante 48 horas. Los pacientes tratados con
tirilazad por 48 horas tuvieron mejoras comparables a los pacientes
tratados con el régimen de 24 horas de MP. Los efectos secundarios
asociados con MP fueron más grandes en pacientes tratados durante 48
horas.
Controversia:
El número creciente de críticos cree que MP ha sido promovido como un
estándar del cuidado para lesiones aguda basada en resultados obtenidos
por el uso de procedimientos estadísticos dudosos. Expresado con
sencillez, el estudio del NASCIS 2 mostró poco si cualquier beneficio
estadísticamente significativo de alta-dosis de alto-dosis MP, y
beneficios modestos sólo fueron demostrados en un subgrupo de paciente
cuando los datos del estudio fueron micro-analizados después de un
desafió de ideas.
Esta controversia no es
insignificante. Por ejemplo, una encuesta de los participantes en una
reunión canadiense Anual de la Sociedad de Espina Dorsal en el
2001indicó: “75% de los correspondientes usaron MP porque los otros lo
usaron o por temor de fallar la no hacer lo.”
La Sociedad canadiense de la
Espina Dorsal y la Sociedad Neura quirúrgica canadiense comisiono una
revisión experta de los datos disponibles de MP, cuales concluyeron que
había evidencia insuficiente para sostener el uso de MP como un estándar
de tratamiento o de pauta, aunque hay la evidencia clínica débil de
sostener su uso como una opción de tratamiento. Las dos sociedades
adoptaron estas recomendaciones (ve sitio web para la Asociación
canadiense de Médicos de Emergencia:
www.caep.ca/002.policies/002-01.guidelines/steriods-acute-spinal.htm).
Parte de los artículos
publicados que desafían el uso de MP como un estándar de tratamiento
incluye, pero no es limitado a, lo Siguiente:
1) Dr. Shanker Nesathurai
(Massachusetts, EEUU) indicó que ni NASCIS 2 o 3 demostraron de forma
convincente los beneficios de MP. "Hay concierne acerca del análisis
estadístico, acerca el escoge al azahar, y acerca de los beneficios
clínicos… Además, los beneficios de esta intervención no pueden
justificar los riesgos posibles.” (J Trauma 45, 1998)
2) Dr. Deborah Short y
colegas (United Kingdom) revisó extensamente la literatura científica
para evaluar la evidencia en el apoyo del uso de MP (Spinal Cord,
38, 2000). Ellos concluyeron: “La evidencia producida por esta revisión
sistemática no sostiene el uso de methylpredinisolone de alta-dosis en
la lesiones aguda de la médula espinal para la recuperación neurológica.
Un efecto desbastador en la mortalidad y la morbosidad tempranas no
puede ser excluida por esta evidencia.”
3) Dr. W.P. Coleman et al
(Maryland, USA) Criticó totalmente ambos NASCIS 2 y 3 por debilidades
metodológicas y la falta de los datos que podrían ser revisados
críticamente por otros (J Disord 13(3 Espinal), 2000). Por ejemplo,
ellos indicaron: “Los números, las mesas, y las figuras en los informes
publicados son escudriñados y son definidos de forma contradictoria,
haciendo lo imposible para que los estadísticos profesionales puedan
duplicar el análisis, adivinando el efecto de cambios en suposiciones, o
suministrando las partes perdidas del retrato. Sin embargo, 9 años
después NASCIS II, los datos primarios no han sido hechos público…Estos
defectos han negado a médicos que la oportunidad de utilizar seguramente
una droga que muchos estuvieron entusiasmados por y los ha dejado en una
posición intolerablemente ambigua en sus elecciones terapéuticas, en su
exposición legal, y en su habilidad de realizar investigación adicional
para ayudar a sus pacientes.”
4) Dr. R.J. Hurlbert (Alberta,
Canadá) concluyó: “El uso de la administración de methylprednisolone en
el tratamiento de SCI aguda no es probado como un estándar del cuidado,
ni puede ser considerado como un tratamiento recomendado. La evidencia
de la eficacia de la droga y el impacto es débil y sólo puede
representar los acontecimientos aleatorios. En el sentido más estricto,
la administración de 24 horas de methylprednisolone debe ser considerada
todavía experimental para el uso en SCI clínico. Cuarenta terapia de
ocho horas no es recomendada” (J Neurosurg 93(1 suppl), 2000).
5) Quizás uno del la mayoría
de las críticas potencialmente maldiciendo, Dr. Tie Qian y colegas (New
Jersey, USA) sugirió la terapia de MP de alta-dosis puede dañar músculos
por miopatía aguda de corticosteroide (ACM) y esa mejora
funcional atribuida a MP solamente puede ser debido a la recuperación
del daño de músculo causado por esta dosis muy alta de MP (Med
Hypothesis 55, 2000). Los investigadores notaron que bajo el
protocolo clínico de NASCI 3, un individuo de 75 kg de lesión aguda
podría recibir casi 22 gm de MP, el cual es la “dosis más alta de
esteroides durante un período de 2 días para alguna condición clínica.”
6) En un informe reciente,
Qian y colegas (Florida, USA) valoró la posibilidad de que la alta-dosis
de MP podría causar daño relacionado con ACM de músculo (Spinal Cord,
43, 2005). Específicamente, cinco pacientes agudamente heridos que
recibieron el régimen del tratamiento de MP de alta-dosis fueron
comparados con tres pacientes controlados, quienes no satisficieron con
los requisitos para el tratamiento de MP (es decir, 2 heridas de bala y
1 llegar al hospital 8 horas después de la lesión). ACM fue valorado por
biopsia muscular y electro miografía (EMG). Biopsias musculares
indicaron que cuatro de los cinco pacientes tratados con MP tuvieron
daño muscular coherente con ACM. El estudio de EMG sostuvo estas
conclusiones. En los controlados, las biopsias musculares fueron
normales, y el EMG no sugirió miopatía. Los investigadores concluyeron
que “la mejora de la recuperación neurológica mostrada por NASCIS puede
ser sólo una grabación de la recuperación natural de ACM, en vez de
alguna protección producida por MP a la médula espinal lesionada.”
7) Estudios en ratas llevados
a cabo Dr. Jianwei Hou et Al (EEUU) documentaron la naturaleza
del daño-muscular de MP cuando se usa como tratamiento después SCI. En
este estudio, las ratas fueron experimentalmente lastimadas al nivel
torácico T9-T10 y tratadas con MP o con el placebo controlado. Siete
días después de la lesión, ambos la masa corporal y muscular disminuyo
apreciablemente en las ratas tratadas con MP comparado con el control.
Los investigadores concluyeron que el MP causa atrofia muscular en ambos
niveles debajo y arriba de la lesión.
8) Dr. Yasuo Ito et Al
(Japón) comparó los resultados de los pacientes a quien se les había
administrado una dosis alta de MP como parte de su cuidado intensivo
contra esos quienes fueron idénticamente tratados sin MP.
Específicamente, entre 2003 Y 2005, todos los pacientes con lesiones
cervicales fueron tratados con un estándar protocolo de MP. En los
próximos dos años, todos los pacientes tratados con lesiones similares
se trataron sin MP. Los dos grupos recibieron el mismo tratamiento, el
único cambio fue el MP. El grupo tratado con MP incluyó a 38 pacientes
(30 hombres; 8 mujeres) la edad promedio fue de 55 años. El grupo que no
fue tratado con MP incluyó a 41 pacientes (33 hombres; 8 mujeres)
promediando 60 años de edad.
La mejora neurológica fue
observada en 45% y 63% de pacientes tratados con MP y los no tratados
con MP, respectivamente. Es decir, los pacientes tratados con MP fueron
aparentemente peor. Además de tener menos mejora, los pacientes tratados
con MP tuvieron una incidencia apreciablemente más grande de pulmonía.
Específicamente, 50% de los pacientes tratados con MP desarrollaron
pulmonía comparado con sólo el 27% de los pacientes que no fueron
tratados con. Los investigadores concluyeron que ellos "no encontraron
evidencia que “la administración de MP facilita la mejora neurológica en
pacientes con lesiones de médula espinal". Ellos también agregaron que
la administración de MP "debe ser utilizada bajo circunstancias
limitadas a causa de la incidencia alta de complicaciones pulmonares".
2)
Sygen® o GM-1 Ganglioside: Como el MP
discutido arriba, el grado de la eficacia de Sygen® o GM-1 ganglioside
(has clic en el cuadro) para promover la recuperación neurológica
después de SCI aguda dependa de la interpretación estadística. Sygen es
el nombre comercial (la Corporación Farmacéutico de Fidia) para un
naturalmente ocurriendo GM-1 ganglioside, un glyco lípido complejo (ve
la figura) encontrado en abundancia en la membrana de la célula de
sistema nervioso central.
Los estudios animales sugieren
que GM-1 ejerce un efecto neura-protector y promueve regeneración
después de la lesión. En la fase aguda de la lesión, esta previene la
muerte adicional de la célula y disminuyendo las consecuencias inducidas
por la lesión por el sobre secrecimiento de neurotransmisores excitantes,
que, en cambio, sobre-estimula sus receptores. 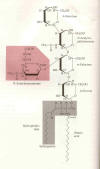 En la fase de lesión
crónica, GM-1 promueve la expresión de factores del crecimiento de
nervio. Además de SCI, los ensayos clínicos sugieren que GM-1
proporciona los beneficios en casos de derrame cerebral y en la
enfermedad de Parkinson.
En la fase de lesión
crónica, GM-1 promueve la expresión de factores del crecimiento de
nervio. Además de SCI, los ensayos clínicos sugieren que GM-1
proporciona los beneficios en casos de derrame cerebral y en la
enfermedad de Parkinson.
Otra vez, como con MP, el uso
GM-1 para tratar SCI aguda fue el enfoco de dos ensayos clínicos
importantes. En el primer, Dr. Fred Geisler et al. (Maryland,
USA) escogió al azahar a pacientes para recibir una dosis de 100 mg
intravenosa de GM-1 o el placebo dentro de 72 horas de la lesión (48
horas promedio) y continuando desde 18 a 32 días (N Eng J Med,
324, 1991). De los 34 sujetos, 23 tenían lesiones cervicales y 11 con
lesiones torácicas; y 32 fueron hombres. Porque todos pacientes fueron
reclutados en un centro, la variabilidad procesal fue intrínsecamente
menos que si este fuese en ensayos multe-centrales.
Todos pacientes recibieron
dosis de 250 mg de MP sobre la admisión y después 125 mg cada seis horas
durante 72 horas. Esta dosis del MP fue mucho menos que esas utilizadas
en el estudio de NASCIS-2, cuyos resultados no fueron sabidos durante
este estudio de GM-1.
Las evaluaciones de
seguimiento fueron llevadas a cabo dos veces a la semana por las
primeras 4 semanas y en 2, 3, 6, y 12 meses que utilizando la escala de
Frankel (grado A [completa], B, C, D & E [motora normal funcionando])
con una puntuación motora de ASIA (0 = completa cuadriplegía; 100 =
función motriz normal).
En de un año, había la mejora
funcional estadísticamente significativa en pacientes tratados con GM-1
compararon con los controlados. Por ejemplo, en el grupo de placebo, 13
pacientes permanecieron en el mismo grado, 4 mejoraron un grado, y 1
mejoró dos grados. Por contraste, en el grupo tratado con GM-1, 8
permanecido en el mismo grado, 1 mejoró un grado, 6 mejoraron dos
grados, y 1 mejoró tres grados. Además, pacientes tratados con GM-1
tuvieron una mejora estadísticamente significativa en la puntuación de
ASIA motriz.
En el segundo tratamiento,
de seis-año de GM-1, Giesler y colegas escogieron al azahar 760
pacientes reclutados de 48 centros norteamericanos de SCI de baja-dosis
de GM-1 (331 pacientes), de alta-dosis GM-1 (99 pacientes) y (330
pacientes) de placebo, los grupos de tratamiento (Spine, 26(24S),
2001). Los grupos fueron subdivididos aún más en seis subgrupos,
utilizando 1) la severidad de la lesión (grado A, B, y combinación de C
+ D) y 2) lesión cervical o torácica.
Todos los pacientes recibieron
inicialmente el régimen de dosis de MP de NSCIS-2 (es decir, la dosis
alta; no la dosis baja utilizada en el estudio anterior de GM-1). El
tratamiento de GM-1 no fue iniciado hasta que el tratamiento de MP fuese
completado, en el promedio de 55 horas después de la lesión. El régimen
de baja-dosis de GM-1 consistió con un comienzo de 300 mg de dosis
cargada seguida por 56 días (es decir, 8 semanas) de un 100 MG/día; la
alta-dosis duplicó estas cantidades. La matriculación en el grupo del
tratamiento de alta-dosis fue terminada más temprano.
Las evaluaciones de
seguimiento fueron realizadas en 1, 2, 4, 6, y 12 meses. La medida
primaria del estudio predefinido de la eficacia de GM-1 fue de la
proporción de pacientes en 6 meses con “recuperación marcada,” definida
usando varias escalas de evaluación de SCI. Una medida secundaria de la
eficacia incluyó el curso de tiempo de la recuperación marcada y otras
medidas establecidas de la función de la médula espinal.
Los resultados del estudio
fueron mezclados y dependieron del tiempo de la evaluación. Por ejemplo,
aunque el grupo tratado con GM-1 no tuviera un número más grande
estadísticamente significativo de pacientes con “recuperación marcada”
en 6 meses (es decir, la medida primaria de la eficacia del estudio),
tuvo la recuperación más grande estadísticamente significativa a fines
del período de dos-mes de dosis, sugiriendo que GM-1 acelera la
recuperación que es obtenida. La droga apareció aumentar la ASIA motora,
el toque de la luz, y las puntuaciones de alfilerazo, así como la
función intestinal, la sensación sacra, y la contracción anal voluntaria.
Finalmente, GM-1 apareció ejercer los efectos más grandes en individuos
con lesiones incompletas.
Aunque el significado
estadístico preliminar no fuese mostrado, el punto final primario, los
investigadores, no obstante, creyeron que GM-1 es “activo en SCI, de
algún modo: en algún respeto, utilizando algún régimen, y en algún grupo
de pacientes.” La posibilidad sugería que MP y GFM-1 pueden tener las
acciones antagónicas, y, como tal, la más alta, la NSCIS-2 recomendó
dosis administradas de MP en el segundo ensayo de GM-1 la cual pudo
disminuir los efectos beneficiosos de GM-1.

3)
Thyrotropin Estimulación de Hormona
(TRH) Es un triple aminoácido péptido de (ácido glutámico-histidina-
proline) producido en el hipotálamo en el cerebro. A pesar de su
sencillez molecular, TRH influye la función biológica diversa afectando
la secreción de una variedad de hormonas, incluyendo la hormona de la
tiroides, la prolactina, la hormona del crecimiento, vasopresina, e
insulina; y los neurotransmisores noradrenalina y adrenalina.
Los estudios experimentales en
modelos animales indican que TRH mejora la recuperación motriz a largo
plazo después de lesión aguda, aparentemente aminorando parte de los
procesos bioquímicos y fisiológicos que median las lesiones secundarias.
En 1995, Dr. Lawrence Pitt y
colegas (California, USA) informó los resultados del tratamiento de 20
pacientes agudamente heridos con TRH reclutados sobre un período de dos-año
desde 1986–1988 (J Neurotrauma 12(3), 1995). Los pacientes fueron
subdivididos en cuatro grupos: 1) lesiones completas e incompletas y 2)
de forma de doble-vendaje, o los grupos tratados con el placebo de TRH.
Los grupos tratados recibieron dóciles de 0.2 mg/kg bolo alimenticio
intravenoso de TRH seguido por una infusión por hora de la misma dosis
durante seis horas.
Los pacientes fueron
examinados en varios períodos de seguimiento utilizando 1) las escalas
motoras y sensoriales en las que 0 correspondió a no movimiento y 5 a
poder normal, y 1 correspondió a no sensación y 3 a sensación normal; y
2) la escala de Sunnybrook del 1-10 en la que 1 representa la perdida
completa sensorial y motora, y 10 representa función motora y sensorial
normal.
En los cuatro-meses antes que
el desgaste de los pacientes empezara a comprometer el estudio, el grupo
tratado con TRH con lesiones incompletas demostraron recuperación
funcional usando las escalas referidas. Sin embargo, ninguna mejora fue
notada en el grupo tratado con TRH de lesiones completas. Los
investigadores acentúan que los resultados deben ser interpretados con
el cuidado debido al pequeño tamaño de la muestra.
Desgraciadamente, a pesar de
los resultados positivos del estudio piloto y muchos estudios
prometedores de animal, ningún trabajo adicional en humanos con SCI
aparece haber sido llevado a cabo. Los esfuerzos de TRH ahora se enfocan
en las lesiones traumáticas de cerebro.

4)
Gacyclidine:
Dr. Alain Privat y colegas (Montpellier, Francia)
han estudiado la eficacia de gacyclidine en aminorar el daño neurológico
después de SCI aguda. Básicamente, después de la lesión, rompimiento de
células, liberando aminoácidos excitantes, tal como glutamato, que
pronto alcanza las concentraciones tóxicas. Por interacciones con
receptores en células vecinas, glutamato en exceso iniciará un cascada
bioquímica neura-toxica. Los estudios animales sugieren que antagonistas
que bloquean estos receptores ejercerán una influencia neura-protectiva
inhibiendo esta cascada. Gacyclidine es uno de estos antagonistas.
El estudio de Privat enlistó a
más de 200 pacientes, un ensayo clínico relativamente grande para SCI (resumido
en Spinal Cord 42, 2004). La mayoría de los sujetos fueron
tratados dentro de tres horas de la lesión y una vez más en las cuatro
horas siguientes. Aunque el análisis de los resultados del estudio
indicara no diferencia estadísticamente significativa entre los grupos
de gacyclidine y los tratados con placebo, los datos sugirieron que
quién 1) recibió la dosis más alta de la droga mejoraron funcionalmente,
y 2) las heridas cervicales sostenidas tuvieron la mayoría de las
mejoras.

5)
Neotrofin®:
NeoTherapeutics (Irvine, California) patrocinó los ensayos clínicos que
examinan el efecto de Neotrofin (llamado también AIT-082 o leteprinim)
en varios desórdenes neurológicos, inclusive la enfermedad de Alzheimer,
la enfermedad de Parkinson, y SCI. Neotrofin es un purine analógico que
puede ser tomado oralmente, y debido a su tamaño relativamente pequeño,
capaz de cruzar la barrera de cerebral-sanguínea, un requisito para
cualquier droga que se concentra en los desórdenes del sistema nervioso
central (CNS).
Los estudios animales indican
que Neotrofin reduce el daño neurológico y mejora el andar después de
lesiones agudas en ratas (Middlemiss, et al. Soc Neurosci Abstr,
25, 1999). La evidencia sugiere que Neotrofin estimula la producción de
factores neuro tróficos, tal como el factor del crecimiento de nervio y
protege las neuronas de muerte inducida por glutamato (vea la sección
previa). Los estudios en ratones indican que la droga estimula también
la proliferación de células madre de CNS, cuál dado la propagación de
las células madres relacionadas con SCI pueden tener implicaciones
importantes.
En 2001, Neo Terapéuticos
comenzó el reclutamiento de 30-40 pacientes con SCI completa de uno a
tres semanas después de la lesión (es decir, la fase sub.-aguda) en
cuatro centros de SCI: La Universidad de Thomas Jefferson
(Pennsylvania), el Centro de Rehabilitación de Craig (Colorado), Rancho
Los Amigo (California), y el Hospital de Gaylord (Connecticut). Los
pacientes consumieron oralmente una dosis dos veces al día de 250 mg de
Neotrofin por 12 semanas.
Desgraciadamente, pocos, si
cualquiera, de los resultados del estudio han sido informados. Después
de que Neotrofin fallara de demostrar un efecto estadísticamente
significativo en ensayos clínicos para la enfermedad del Alzheimer, el
casi roto NeoTherapeutics se reorganizó en Espectro Farmacéuticos con un
énfasis en drogas de cáncer.

6)
Minocycline:
Un antibiótico del amplio espectro en el grupo de
tetracyclina, minocyclina a menudo es utilizado para tratar el acné y la
rosácea. Comparado a otro tetracyclinas, minocyclina es eliminado más
lentamente del cuerpo, y, de ahí, ejerce un efecto fisiológico más
largo.
Los estudios en modelos
animales de SCI aguda indican que minocyclina aminora el daño
neurológico secundario que ocurre pronto después de la lesión. Por
ejemplo, investigadores de la Universidad de Calgary han mostrado que
ratones tratados con minocyclina agudamente herido recuperan la función
del miembro trasero y la fuerza compararon a ratones sin tratamiento.
Además, minocyclina redujo el tamaño de la lesión y promovió la sobre
vivencia del axon en el área lesionada (Wells JE, et al, Brain,
126(7), 2003). La Universidad de Harvard (Teng YD et al, Proc Natl
Acad Sci, 101(9), 2004) e investigadores surcoreanos (Lee SM et al,
J Neurotrauma, 20(10), 2003) han demostrado también los efectos
semejantes neuro-protectivos en ratas.
Minocyclina media sus efectos
de neuro-protectivos por varios mecanismos, inclusive aminorar el
destructivo, respuesta inmunitaria de anuncia-herida y la liberación de
cytochrome C. Aunque cytochrome C sea una proteína célula-respiratorio
clave esencial para la vida de la célula, cuando es liberado, inicia una
cascada metabólica que provoca la muerte de la célula.
Basado en los resultados de estos estudios animales, Dr. R. John
Hurlbert, Dr. Steven Casha, y colegas (Canadá) han iniciado
unos estudios al azar, de doble vendaje, placebo-control, de fase-1 y -2
que evalúan la administración de minociclina dentro de 12 horas de
lesión. Sesenta sujetos con lesiones en o encima del nivel T11 torácica
son de ser alistado cumulativamente. La minociclina será administrada
intravenosamente dos veces al día durante siete días. Los sujetos de
control recibirían una infusión salina. Los pacientes serán seguidos por
dos años que utilizan una variedad de evaluaciones, incluyendo ASIA
motora y puntuaciones sensorias, la Evaluación de Calidad de Vida, y la
Medida Funcional de Independencia.

7)
Cethrin®
Basado en una base de investigación por Dr. Lisa McKerracher et
Al (Canadá), Productos Farmacéuticos de Alseres han iniciado ensayos
clínicos que evalúan Cethrin en pacientes con SCI aguda. Los estudios
animales indican que SCI 1) estimula la producción de Rho, una molécula
que inhibe el crecimiento y la regeneración de los axones, y 2) inicia
una cascada fisiológica que tiene como resultado la muerte de células
cercanas a neuronas (un proceso llamó apoptosis). Cethrin bloquea
aparentemente estos efectos adversos, restaurando el potencial
regenerador y que previene la muerte de célula.
El ensayo clínico inicial fue
diseñado para probar la seguridad de Cethrin y su farmo-cinetica en
varios regímenes que medican, y no incluyeron sujetos del control
necesarios para determinar la eficacia general. La droga fue
administrada un promedio de 53 horas después de la lesión en aquel
momento de estabilización espinal/la cirugía de descompresión, un
procedimiento a menudo hecho pronto después de la lesión. Como la
cirugía es completada, Cethrin fue aplicada en la membrana que cubre la
médula espinal que utiliza un sellador para mantenerla en lugar. La
droga penetra por la membrana al tejido neuronal fundamental.
Alistado en nueve sitios
norteamericanos, los 37 sujetos tuvieron inicialmente lesiones de ASIA-A
(grado A el más paralizado; grado E normal). En seis meses, 28% mejorado
por uno o más grados de ASIA, con cinco sujetos que mejoran dos grados y
dos mejoraron tres grados. Por la comparación, los datos históricos
sugieren que sólo 6,7% de pacientes tendría este grado de mejora. Los
resultados sugieren que los pacientes con lesiones cervicales acumularon
el beneficio más grande del tratamiento.
En aquel momento de este
informe, Productos Farmacéuticos de Alseres han indicado su intención
para iniciar un estudio mucho más grande, que alistará 200 sujetos con
lesiones cervicales C5-7de ASIA-A.

8)
Tacrolimus & Minocycline:
Aunque detalles disponibles sean escudriñados, los investigadores
en el Hospital de Fuerzas armadas de Riad, Arabia Saudita ha iniciado un
ensayo clínico que valora la eficacia de tacrolimus y minocyclina de
reducir el daño neurológico después de SCI aguda. Minocyclina es
discutido arriba. Tacrolimus (también llamado FK506) es un antibiótico
originalmente obtenido de bacterias de tierra. Es utilizada
primordialmente para 1) suprime el sistema inmunológico para aminorar el
rechazo de órganos trasplantados y 2) tratar el eczema tópicamente. Los
estudios animales sugieren que esta ejerce un efecto neura protector que
puede ser mejor que el methylprednisolone actualmente extensamente
utilizado (Neurol 1998; 154(2); Exp Neurol 1999; 158(2);
Exp Neurol 2002; 177(1); & J Neurosci Res 2005; 81(6)).
Tacrolimus inhibe calcineurin, una enzima encontrada en neuronas y
linfocitos (glóbulos blancos). Esta inhibición previene aparentemente la
activación de linfocitos, atenuando en cambio la destrucción, el proceso
inmunológico después de la lesión.

9)
Lipitor (Atorvastatin):
Usado para bajar el colesterol en sangre, Lipitor es uno del más
extensamente utilizado en esta sociedad - así como provechoso - las
drogas. Interesantemente, los estudios animales sugieren que esta droga
comúnmente utilizada puede preservar alguna función después de SCI.
Específicamente, Dr. Avtar Singh y colegas (Carolina del sur, EEUU)
trató ratas con lesiones de contusión (es decir, comparable con las
lesiones observadas en la mayoría de los humanos) con dosis orales (5
miligramos por kilogramo de peso corporal) de Lipitor 2, 4, o 6 horas
después de la lesión seguida después por una dosis una vez diaria (24).
Comparado a controles, las ratas tratadas con Lipitor recobraron
considerable función de los miembros traseros. Mientras más temprano los
tratamientos mayores fueron las funciones recobradas por las ratas.

Aparentemente, Lipitor ayudó a
preservar la barrera espinal entre sangre-cuerda después de la herida,
cual, en cambio, limitó la infusión en el sitio lesionado de varias
moléculas inflamadoras que promueven el daño secundario cual compromete
la función. En términos generales, había más tejido que reserva en ratas
de tratadas con Lipitor. Específicamente, había menos degeneración de
axones neuronales; la degradación promotora de la conducción, vaina de
mielina guardando el axon; gliosis formando la cicatriz (la producción
de un complejo denso de células neuronales de apoyo llamadas glia en el
área lesionada); y la muerte neuronal programada de células madre
apoptosis. Como Cethrin discutió arriba, Lipitor suprime la expresión de
Rho, una molécula inhibidora de la regeneración.

10)
Erythropoietin (EPO): EPO
(Epogen®) es una hormona glicoproteina del crecimiento producida por el
riñón que estimula la producción de glóbulos rojos en la médula ósea. En
una forma de comunicación en reacción donde disminuciones en niveles de
oxígeno en sangre provoca la síntesis de EPO, que, en cambio, tiene como
resultado la creación de más glóbulos rojos cargando oxígeno. EPO ha
sido utilizado principalmente en el tratamiento de enfermedad renal,
donde la producción de EPO ha sido comprometida, y en cáncer para
mejorar los efectos secundarios de la quimioterapia- o la anemia
inducida por la radiación. A causa de la habilidad de EPO de promover la
oxigenación, atletas de resistencia han utilizado la droga como un
agente para dopar la sangre para obtener una ventaja competitiva.
Más reciente, se ha sido mostrado
que EPO es creado también por el CNS y ejerce una influencia de neura
protectiva para una variedad de desórdenes neurológicos, incluyendo el
embolismo, traumas a la cabeza, y SCI. En el caso de SCI en modelos
animales, varios mecanismos fisiológicos de interacción pueden mediar
una influencia neura protectiva asía EPO: Específicamente, EPO
·
Bloquea la muerte de células relacionadas
con la lesión llamada apoptosis;
·
previene hipoxia relacionado con la lesión
en el cual el oxígeno en limitación alcanza la médula espinal;
·
inhibe el daño causado por excitotoxins,
aminoácidos que, cuando se elevan por la herida, daña las células
neuronales vecinas;
·
reduce inflamación en sitio lesionado;
·
restaura la integridad vascular después de
la lesión, aumentando el riego sanguíneo y, en cambio, la oxigenación
del tejido;
·
aumenta regeneración neuronal por el
estímulo de células madres para producir nuevas neuronas y células de
apoyo.
Dado el efecto documentado neura
protector de EPO en animales lesionados, investigadores italianos han
iniciado un ensayo clínico multe-central que compara la eficacia de EPO
con methylprednisolone (discutió previamente) para tratar SCI aguda. El
estudio intenta enlistar 100 sujetos en centros italianos de SCI dentro
de ocho horas de la lesión y los sortearlos para que reciban EPO o MP.
Todos los sujetos deben tener más lesiones completas de A-B por ASIA (es
decir, la más grave de las lesiones neurológicas completas; vea
apéndice). La mejora relativa será medida periódicamente más de tres
meses que utilizan la escala de impedimento de ASIA, así como las
evaluaciones de conducción neuronal (es decir, la electrofisiología),
espasticidad, el dolor, y autonomía funcional.

11)
Anta-Nogo: Desde que los 1980, Dr. Martin Schwab y colegas
(Suiza) han estado investigando los factores que inhiben regeneración
neuronal después de la lesión y, en cambio, lo que bloquea estos
factores como un medio para promover la recuperación funcional.
 Su
investigación fue basada en las conclusiones por otros, que mostró
generalmente regeneración tardía, las neuronas de la médula espinal
pueden crecer cuando se colocan en el sistema nervioso periférico (PNS -
nervios fuera del cerebro y la médula espinal). Estas conclusiones
sugirieron que un factor ambiental del CNS inhibía la regeneración
neuronal que no existió en el PNS. Schwab demostró el factor estaba
asociado con la mielina del CNS, la materia que forra las neuronas. La
mielina del CNS y del PNS es diferente, engendrados por células
diferentes llamadas oligodendrocitos y células de Schwann. La mielina de
oligodendrocito derivada del CNS posee una proteína doblada Nogo que
repela los conos del crecimiento en axones neuronales atentando una
regeneración. Para anular esta inhibición, el equipo de Schwab
desarrolló un anticuerpo que complejo con Nogo, de ahí, neutralizando o
para bloquear a Nogo.
Su
investigación fue basada en las conclusiones por otros, que mostró
generalmente regeneración tardía, las neuronas de la médula espinal
pueden crecer cuando se colocan en el sistema nervioso periférico (PNS -
nervios fuera del cerebro y la médula espinal). Estas conclusiones
sugirieron que un factor ambiental del CNS inhibía la regeneración
neuronal que no existió en el PNS. Schwab demostró el factor estaba
asociado con la mielina del CNS, la materia que forra las neuronas. La
mielina del CNS y del PNS es diferente, engendrados por células
diferentes llamadas oligodendrocitos y células de Schwann. La mielina de
oligodendrocito derivada del CNS posee una proteína doblada Nogo que
repela los conos del crecimiento en axones neuronales atentando una
regeneración. Para anular esta inhibición, el equipo de Schwab
desarrolló un anticuerpo que complejo con Nogo, de ahí, neutralizando o
para bloquear a Nogo.
Como una analogía cruda, visualice
los inhibidores del Crecimiento de Nogo como una fibra atasca en su ropa
a menos que esta este llena de pelusas haciendo que se caiga la fibra
lejos. Esencialmente, los anticuerpos de anta-Nogo representan las
pelusas moleculares quienes se pegan de manera preferencial al Nogo,
previniendo que se conecte a los conos del crecimiento quienes luchan
por la supervivencia. Estos conos regenerados ahora pueden adelantarse
en la médula espinal sin obstáculo inhibitorio.
En varios modelos animales con SCI,
incluyendo ratas y primates, Schwab y colegas han mostrado que los
anticuerpos anta-Nogo promueven la recuperación funcional. Esta
recuperación es aparentemente debido a no sólo la regeneración de
neuronas afectadas por la lesión pero a la estimulación asía las
neuronas que brotan sobre pasando el sitio lesionado. Basado en estos
experimentos, la compañía suiza Novartis en la colaboración con Schwab
ha iniciado los ensayos clínicos preliminares en humanos lesionados
dentro de 10 días del tratamiento.

12)
Ibuprofeno: Aunque
el potencial de ibuprofeno para tratar SCI sólo haya sido explorado en
modelos animales (como Lipitor discutió arriba), esta droga es incluida
en esta discusión porque su consumo esparcido lo hace un candidato mucho
más fácil de ser considerado para aplicaciones de SCI. Vendido bajo
muchos nombres de marca (por ejemplo, Advil, Motrin, etc), ibuprofeno es
clasificado como una droga antiinflamatoria sin esteroides (NSAID – como
aspirina). La droga trabaja inhibiendo la producción de prostaglandinas,
que media la inflamación.
Como en el caso tanto de
Cethrin como Lipitor resumidas anteriormente, ibuprofeno bloquea la
producción de Rho provocado por la lesión. Otra vez, Rho es una proteína
que inhibe el crecimiento y la regeneración de los axones, e inicia una
cascada fisiológica que últimamente tiene como resultado la muerte de
células cerca de las neuronas (un proceso llamó apoptosis).
El Dr. Shuxin Long
Island y colegas (EEUU) han mostrado eso bloqueos de Rho, ibuprofeno
estimula el crecimiento de no sólo neuronas crecidas en la cultura pero
dentro de la médula espinal lesionada. Específicamente, una inyección
subcutánea (a través de mini-bomba) de ibuprofeno en ratas con SCI
experimental estimuló considerable la expansión de axones. Comparado a
animales sin tratamiento de control, las ratas tratadas con ibuprofeno
recobraron capacidad adicional del caminar. Los investigadores
concluyeron que "ibuprofeno promueve una recuperación funcional
remarcable, locomotriz y notable, aún cuando se da 1 semana después
del trauma. El efecto que promueve el crecimiento de axones y el uso
común de ibuprofeno en pacientes elevan la posibilidad de que" puede ser
un tratamiento efectivo para SCI.
El Dr Stephen
Strittmatter et Al (EEUU) confirmó y extendió estas conclusiones.
Específicamente, las bombas implantadas bajo la piel en ratas con
lesiones experimental de contusión les entregaron ibuprofeno por 28 días
comenzando tres días después de la lesión. Ajustándole la dosis con el
peso, el ibuprofeno en estas ratas fue comparable al consumido por
muchos humanos en una base progresiva. Los investigadores mostraron que
el ibuprofeno 1) no sólo bloquea el inhibidor de Rho-Regeneración
discutido arriba, pero también un glicoproteína asociado con la de
mielina que dificulta el crecimiento neuronal; 2) estimula la expansión
de algunos, pero no todo, los tipos de axones; y 3) protege y reserva el
tejido de médula espinal en el sitio de lesionado. Comparado a controles,
más ratas tratadas con ibuprofeno pudieron andar; el doble pudo apoyar
su peso con los miembros traseros. Este efecto de función-restauración
persistió mucho después de que el tratamiento de ibuprofeno hubiera sido
discontinuado, indicando que fue debido a un cambio persistente en la
anatomía o la función neuronal y no sólo un efecto transitorio de droga.
13)
Riluzole:
El Dr. Robert Grossman (EEUU) y colegas en varios centros
norteamericanos de SCI han iniciado un ensayo clínico preliminar que
evalúa la seguridad y farmacocinética (es decir, cómo una droga es
metabolizada por el cuerpo) de tratar a 36 pacientes con SCI con
riluzole. Los pacientes con lesiones de C4-T12 serán administradas 50
miligramos de la droga dos veces al día por dos semanas que comienzan
dentro de 12 horas de la lesión. Además del enfoque de la seguridad y la farmacocinética, una evaluación
preliminar de resultados funcionales será emprendida por planear un
estudio más completo de eficacia fase-II.
Además del enfoque de la seguridad y la farmacocinética, una evaluación
preliminar de resultados funcionales será emprendida por planear un
estudio más completo de eficacia fase-II.
Riluzole ejerce varios
mecanismos neuro-protectivos, incluyendo 1) limitación a la entrada de
poste-lesión de dañar iones de sodio en neuronas, bloqueando los canales
en membrana por cuales los iones entran o 2) inhibiendo la liberación de
ciertos neurotransmisores excitantes de aminoácido provocado por la
lesión, que en niveles excesivos son neurotóxicos.
Numerosos ensayos clínicos se
han concentrado en la capacidad de Riluzole para tratar una gran
variedad de desórdenes neurológicos, incluyendo amiotrofia esclerosis
lateral (AL), la esclerosis múltiple, la esquizofrenia, la Enfermedad de
Parkinson, síndrome de Tourette, la depresión, etc.
El foco de ensayos clínicos es
basado en una en estudios prometedores de animales, incluyendo lo
siguiente:
1) el Dr. J.M. Stutzmann
et Al. (Francia) evaluó los efectos de 10 días de tratamiento de
riluzole en ratas con lesiones torácicas engendradas por compresión de
médula espinal. Comparado a controles, ratas tratadas con riluzole
recuperaron mayor función, demostraron mejoras en la conducción de
nervio por el sitio lesionado, y tuvieron menos daño de tejido en el
sitio lesionado.
2) el Dr. Xiaojun Mu y
asociados (EEUU) trataron ratas con una lesiones de contusión a nivel de
T10 con riluzole, methylprednisolone (MP discutido arriba), o una
combinación de dos. Riluzole fue administrada intraperitonealmente (es
decir, en la cavidad del cuerpo) dos y cuatro horas después de la lesión
y después diariamente por una semana. MP fue administrado
intravenosamente sólo dos y cuatro horas después de la lesión. El
potencial de neuro-protejedor fue valorado evaluando 1) la recuperación
de la función del miembro trasero, 2) tejido reservado en el sitio
lesionado, y 3) la cantidad de axones reparados con mielina, una
indicación de neuronas funcionales. Dado a las limitaciones del estudio,
sólo el tratamiento combinado de MP/riluzole mostró mejoras de la
función miembro trasero y reservación de tejidos en el sitio lesionado.
3) los Drs. Gwen Schwartz y
Michael Fehlings (Canadá) trató ratas lesionadas con dosis de
riluzole intraperitoneal y con varias drogas interinas semejantes. Las
drogas fueron administradas 15 minutos después de una lesión
experimental producida sujetando la médula espinal expuesta en la región
C7-T1. Después de que función de las patas traseras se evaluara por seis
semanas, los animales fueron sacrificados y el grado de tejido
reservado anatómicamente examinado. La recuperación y el tejido
funcionales de reserva fueron aumentados apreciablemente en animales de
tratados con riluzole. Los investigadores concluyeron que "Riluzole
debe ser considerado como un candidato terapéutico importante para esta
forma de trauma de SNC".
Después de que función de las patas traseras se evaluara por seis
semanas, los animales fueron sacrificados y el grado de tejido
reservado anatómicamente examinado. La recuperación y el tejido
funcionales de reserva fueron aumentados apreciablemente en animales de
tratados con riluzole. Los investigadores concluyeron que "Riluzole
debe ser considerado como un candidato terapéutico importante para esta
forma de trauma de SNC".
4) el Dr. Ozkan Ates y
colegas (Turquía) trataron ratas lesionadas con riluzole u otros agentes
de neuro-proctetivo (46). Una dosis única de la droga fue administrada
intra-peritonealmente inmediatamente después de que una lesión
experimental de contusión fuera producida en el nivel T7-10. Varias
escalas fueron utilizadas semanalmente por seis semanas para valorar la
recuperación de función- motor. Además, evaluaciones anatómicas y
bioquímicas de daño del sitio lesionado fueron llevadas a cabo.
Comparado a controles con dosis-salina, las ratas de tratadas con
riluzole 1) recuperaron mayor función motriz, 2) tuvieron lesiones más
pequeñas en el sitio lesionado, y 3) tuvieron menos per-oxidación de
lípido, un proceso bioquímico que media el daño neurológico secundario a
la cuerda lesionada.
5) el Dr. Patrick
Kitzman (EEUU) examinó si riluzole puede reducir espasticidad de
cola en ratas regenerada por SCI. Las médulas espinales de las ratas
fueron transectadas en el nivel S2 sacra, un tipo de lesión que produce
coherentemente la espasticidad en músculos de cola. Los animales fueron
tratados durante tres días con o una solución salina de placebo o dos
dosis diferentes de riluzole. Dependiendo en la dosis, los animales
tratados con riluzole tuvieron menos espasticidad de cola.
TOP